Mở cửa 7h30 - 17h00 / T2 - CN xuyên trưa
Trong bối cảnh thế giới đang đối mặt với nhiều loại siêu vi kháng thuốc, dân số già hóa và sự gia tăng của các bệnh tự miễn cùng ung thư, kháng thể đơn dòng mở ra một kỷ nguyên điều trị mới chính xác hơn, cá thể hóa hơn và đầy tiềm năng đột phá. Không chỉ giúp phát triển các liệu pháp nhắm trúng đích, kháng thể đơn dòng còn mang đến cái nhìn sâu sắc về cơ chế gây bệnh phức tạp ở con người, góp phần thay đổi cách y học hiện đại tiếp cận, điều trị và kiểm soát các bệnh lý nguy hiểm.
Bài viết được tư vấn chuyên môn bởi BS Phạm Hồng Thuyết, Quản lý Y khoa Vùng 1 – Mekong, Hệ thống tiêm chủng VNVC.

Kháng thể đơn dòng (Monoclonal Antibodies – mAb) là kháng thể nhân tạo sản sinh từ một dòng tế bào, vì chỉ gồm một kiểu globulin miễn dịch (protein giúp cơ thể nhận biết và vô hiệu hóa các tác nhân gây bệnh như vi khuẩn, virus…). Nói cách khác, “đơn dòng” nghĩa là các kháng thể này là bản sao của một kháng thể gốc và chỉ liên kết với một kháng nguyên nhất định. Nhờ tính đặc hiệu cao, kháng thể đơn dòng đã trở thành nền tảng trong các phương pháp điều trị hiện đại, từ ung thư, bệnh miễn dịch, huyết học đến các bệnh truyền nhiễm.
Kháng thể đơn dòng phát triển mạnh mẽ kể từ khi được Tiến sĩ Kohler và Tiến sĩ Milstein giới thiệu lần đầu vào năm 1975. Kỹ thuật này dựa trên việc tiêm một chất kích thích miễn dịch (kháng nguyên) vào động vật có vú, thường là chuột, để cơ thể chúng tạo ra các kháng thể đặc hiệu. Các tế bào sản xuất kháng thể này sau đó được lấy ra và kết hợp với các tế bào u tủy có khả năng sống lâu, tạo thành các tế bào lai có thể sản xuất kháng thể đơn dòng liên tục, phục vụ nghiên cứu và điều trị.
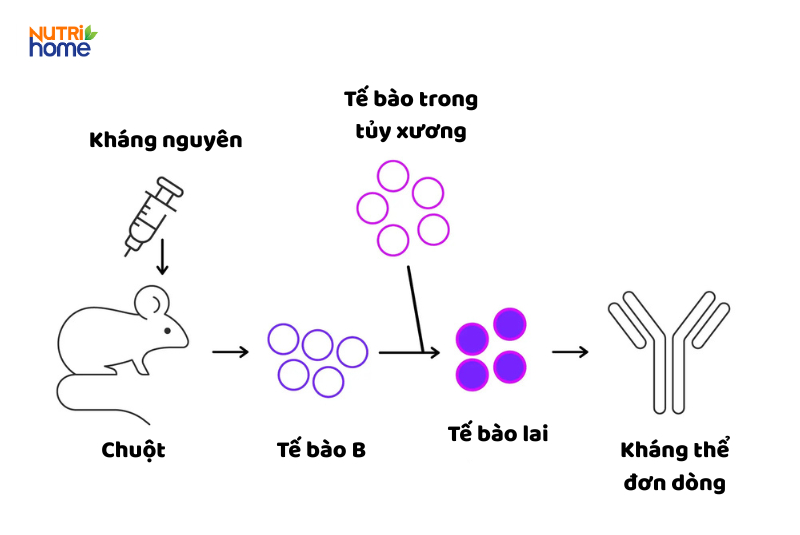
Kháng thể đơn dòng có nguồn gốc từ tế bào lai hybridoma đóng vai trò là công cụ chính xác để phát hiện và phân tích các phân tử sinh học.
Có 5 lớp kháng thể trong cơ thể người: IgM, IgD, IgG, IgE và IgA, mỗi loại đảm nhận chức năng riêng trong hệ miễn dịch. Trong số này, IgG là dồi dào nhất và được chia thành bốn phân lớp dựa trên cấu trúc của chúng. Đối với liệu pháp kháng thể đơn dòng (mAb), IgG là loại duy nhất được sử dụng nhờ những ưu điểm như độ ổn định cao, khả năng sinh miễn dịch thấp, ít tác dụng phụ và dễ sản xuất số lượng lớn.
Ban đầu, kháng thể đơn dòng thường thuộc lớp kháng thể immunoglobulin G (IgG), nhưng với các tiến bộ trong công nghệ sinh học tái tổ hợp và hóa học protein, ngày nay đã có nhiều dạng mới như mAb chimeric, đoạn mAb, mAb miền đơn và mAb đa đặc hiệu. Những dạng này mang lại nhiều lợi ích quan trọng, bao gồm nâng cao hiệu quả điều trị, cải thiện độ ổn định, tăng sinh khả dụng và mở rộng khả năng nhắm mục tiêu nhiều kháng nguyên. Hiểu rõ các dạng mAb khác nhau là chìa khóa để đảm bảo an toàn, chất lượng và hiệu quả trong ứng dụng lâm sàng.
Kháng thể đơn dòng có khả năng nhắm mục tiêu rất chính xác nhờ các vùng đặc hiệu (CDR) trên mảnh Fab, cho phép liên kết với kháng nguyên đích mà hạn chế ảnh hưởng đến các tế bào khác. Vùng Fc giúp kích hoạt hệ thống miễn dịch, bao gồm các tế bào miễn dịch và hệ bổ thể, để phá hủy mục tiêu.
Đối với miễn dịch dự phòng, cụ thể là kháng thể đơn dòng RSV, sinh phẩm này nhắm trực tiếp vào virus hợp bào hô hấp (RSV) để ngăn ngừa nhiễm trùng, đặc biệt ở trẻ sơ sinh và nhóm nguy cơ cao. Các kháng thể đơn dòng này hoạt động bằng cách liên kết đặc hiệu với protein F của virus, ngăn chặn virus xâm nhập vào tế bào và kích hoạt hệ miễn dịch hỗ trợ loại bỏ mầm bệnh. Nhờ tính đặc hiệu cao, liệu pháp này có thể bảo vệ hiệu quả mà không tác động đến các tế bào hoặc hệ miễn dịch khác. Ví dụ điển hình là Beyfortus, được phát triển để tiêm dự phòng, giúp giảm đáng kể nguy cơ nhiễm RSV nặng ở trẻ nhỏ trong mùa dịch.
Trong điều trị ung thư, kháng thể đơn dòng có thể ức chế các tín hiệu quan trọng của tế bào ung thư, gây chết tế bào hoặc đưa thuốc trực tiếp vào tế bào ác tính. Chúng cũng có thể huy động hệ miễn dịch để tấn công tế bào ung thư qua các cơ chế như độc tính tế bào phụ thuộc bổ thể, thực bào qua trung gian kháng thể và độc tính tế bào phụ thuộc kháng thể. Một số kháng thể đơn dòng như Bevacizumab, nhắm vào mạch máu nuôi khối u, làm chậm sự phát triển của khối u.
Ngoài ra, kháng thể đơn dòng còn được sử dụng trong các bệnh tự miễn như viêm khớp dạng thấp, bệnh viêm ruột hay lupus. Chúng nhắm vào các phân tử gây viêm, giúp giảm phản ứng viêm và cải thiện triệu chứng. Ví dụ, Adalimumab là một kháng thể đơn dòng ức chế TNF-alpha, làm giảm các cytokine và dấu ấn viêm, mang lại hiệu quả rõ rệt cho bệnh nhân viêm khớp dạng thấp.
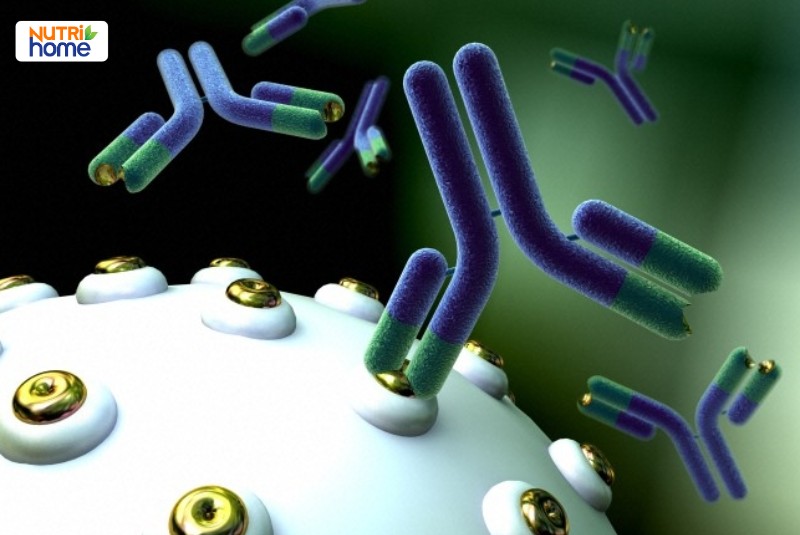
Các hình chữ “Y” màu xanh lam và xanh lục biểu thị các kháng thể đơn dòng trong quá trình liên kết với các thụ thể có trên bề mặt tế bào.
Theo các chuyên gia y tế, kháng thể đơn dòng có nhiều loại và mỗi loại chỉ liên kết với một kháng nguyên nhất định. Có nhiều cách phân loại kháng thể đơn dòng, trong đó phổ biến nhất là theo nguồn gốc, tên gọi và tác động cụ thể:
Kháng thể đơn dòng thế hệ đầu tiên được phát triển từ tế bào lai chuột và có hậu tố “-omab”. Rituximab là ví dụ điển hình, được ứng dụng trong điều trị u lympho và một số bệnh tự miễn. Tuy nhiên, cấu trúc hoàn toàn từ chuột có thể kích hoạt phản ứng HAMA ở người, gây ra sốc phản vệ hoặc bệnh huyết thanh, đồng thời làm giảm hiệu quả do kháng thể bị thải trừ nhanh chóng.
Từ những hạn chế đó, kỹ thuật di truyền đã tạo ra kháng thể khảm, kết hợp vùng biến đổi của chuột với vùng cố định của người. Nhóm này có hậu tố “-ximab”, như infliximab, được chỉ định trong các bệnh viêm mạn tính. Sau đó, kháng thể người hóa ra đời với cấu trúc gần như toàn bộ từ người, chỉ giữ lại phần nhỏ nhận diện kháng nguyên, điển hình như trastuzumab trong ung thư vú HER2 dương tính. Cuối cùng, kháng thể nhân hóa hoàn toàn như adalimumab được phát triển hoàn toàn từ gen người, giúp tối ưu tương thích và hạn chế sinh miễn dịch trong điều trị tự miễn.
Việc đặt tên cho các kháng thể đơn dòng không phải là tùy ý của nhà nghiên cứu hay công ty dược, mà được Tổ chức Y tế Thế giới (WHO) quy định chặt chẽ theo Danh pháp Quốc tế (INN – International Nonproprietary Names). Mỗi tên kháng thể được cấu trúc theo một mã ngữ âm học đặc trưng, giúp xác định rõ mục tiêu điều trị, nguồn gốc, cấu trúc và đặc tính sinh học của thuốc.
Một tên kháng thể đơn dòng cổ điển gồm 3 phần:
Ví dụ, trong tên trastuzumab:
Từ năm 2022, WHO đã điều chỉnh quy ước đặt tên, đơn giản hóa bằng cách giữ lại một tiền tố xác định mục tiêu và một hậu tố thể hiện cấu trúc.
Tiền tố: phần mở đầu do nhà phát triển chọn, không mang ý nghĩa khoa học mà thiên về tính nhận diện thương mại.
Trung tố đầu tiên: mô tả mục tiêu điều trị, ví dụ:
Trung tố thứ hai: biểu thị nguồn gốc hoặc mức độ “người hóa” của kháng thể:
Ví dụ, infliximab có -liximab, cho biết đây là kháng thể chimeric (lai giữa người và chuột) dùng trong điều trị bệnh tự miễn.
Hậu tố: Các hậu tố giúp mô tả cấu trúc và tính năng đặc biệt của kháng thể:
Một số kháng thể còn có tên ghép thứ hai để biểu thị sự kết hợp với các chất khác:
Một số ví dụ tiêu biểu trong y học hiện nay:
Các kháng thể đơn dòng cũng có thể được phân loại dựa trên chức năng, chẳng hạn như sử dụng trong điều trị ung thư, bao gồm: mAb trần (không liên hệ), mAb liên hợp và mAb hai đặc hiệu.
Dựa trên cấu trúc và cơ chế tác động, kháng thể đơn dòng thường được chia thành ba nhóm chính: kháng thể trần, kháng thể liên hợp, và kháng thể hai đặc hiệu. Mỗi loại mang một cơ chế riêng, cùng hướng đến mục tiêu chung là tiêu diệt tế bào ung thư một cách chọn lọc và hiệu quả. Cụ thể:
Trong trường hợp kháng thể đơn dòng được phát triển dựa trên đích tác động là miễn dịch, sinh phẩm sẽ nhắm vào các phân tử tham gia điều hòa hoặc kích hoạt hệ miễn dịch, giúp tăng cường hoặc điều hòa phản ứng miễn dịch trong các bệnh tự miễn hoặc viêm mạn tính.
Nếu nhắm vào đích tác động là vi sinh vật, kháng thể đơn dòng thường sẽ nhắm vào virus, vi khuẩn hoặc độc tố vi sinh vật, ngăn chặn sự xâm nhập vào tế bào và hỗ trợ hệ miễn dịch loại bỏ tác nhân gây bệnh. Ví dụ điển hình là kháng thể đơn dòng RSV để phòng ngừa nhiễm virus ở trẻ sơ sinh và trẻ nhỏ, đặc biệt ở nhóm trẻ có nguy cơ cao lây nhiễm và mắc bệnh nặng do RSV gây ra.
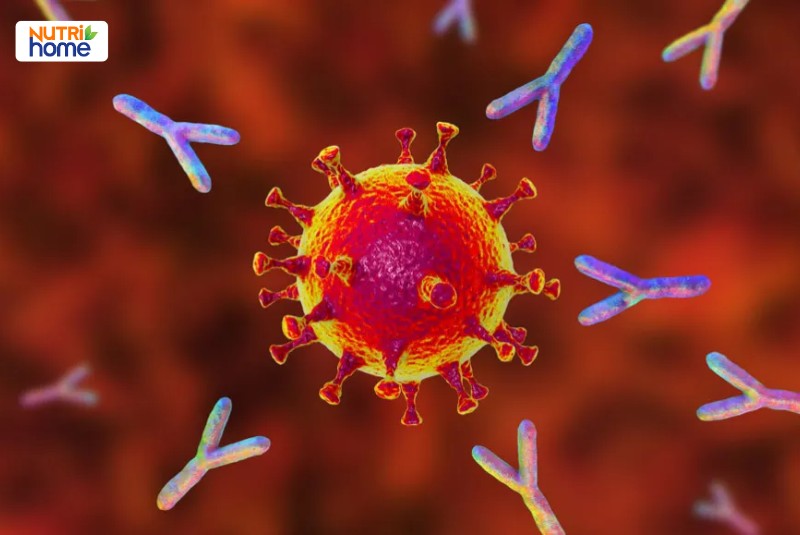
Kháng thể đơn dòng có nhiều loại và mỗi loại chỉ liên kết với một kháng nguyên nhất định.
Chính nhờ khả năng nhận diện và gắn kết đặc hiệu với nhiều loại phân tử, chủ yếu là protein, mà kháng thể đơn dòng được ứng dụng rộng rãi trong y học hiện đại. Trong chẩn đoán, kháng thể đơn dòng giúp phát hiện hormone, vitamin, cytokine (chất gây viêm), chất gây dị ứng, các dấu hiệu của khối u và nhiều yếu tố liên quan đến bệnh lý, kể cả nhiễm khuẩn. Nhờ độ chính xác cao, mAb trở thành công cụ không thể thiếu trong xét nghiệm lâm sàng, xác định dấu ấn sinh học và mục tiêu điều trị.
Không chỉ dừng lại ở chẩn đoán, kháng thể đơn dòng còn mở ra kỷ nguyên mới trong điều trị. Chúng được dùng để điều trị ung thư, bệnh viêm mạn tính, rối loạn tự miễn, dị ứng như hen suyễn, thoái hóa điểm vàng, đa xơ cứng, loãng xương… và đang được nghiên cứu cho các bệnh lý phức tạp như Alzheimer, tiểu đường hay đau nửa đầu.
Trong điều trị ung thư, kháng thể đơn dòng có thể gắn vào các kháng nguyên trên bề mặt tế bào ung thư để tiêu diệt chúng trực tiếp hoặc mang theo “tải trọng” như độc tố, thuốc, chất phóng xạ hay tế bào miễn dịch đặc hiệu nhằm tấn công chính xác vào tế bào bệnh. Những liên hợp này giúp tăng hiệu quả điều trị, giảm tác dụng phụ và mở đường cho y học cá thể hóa, hướng điều trị phù hợp nhất cho từng người bệnh.
Cụ thể về các ứng dụng của kháng thể đơn dòng như sau:
Nếu trước đây, việc chẩn đoán nhiễm khuẩn phải mất nhiều thời gian và trải qua quy trình phức tạp, thì nay, vật liệu nano với các đặc tính điện, từ, phát quang đặc biệt đã giúp rút ngắn đáng kể thời gian xét nghiệm, đồng thời tăng độ nhạy và khả năng phát hiện vi khuẩn chỉ trong vài chục phút.
Khi được “gắn” với kháng thể, các hạt nano trở thành đầu dò siêu nhỏ nhưng cực kỳ nhạy, có thể xác định chính xác vi khuẩn gây bệnh như E. coli hay Mycobacterium, thậm chí trong các mẫu phức tạp như máu hoặc sữa. Đặc biệt, hạt nano từ tính và chấm lượng tử phát quang giúp theo dõi vi khuẩn, tế bào gốc hoặc thuốc trong cơ thể bằng kỹ thuật hình ảnh hiện đại, hỗ trợ mạnh mẽ cho chẩn đoán và nghiên cứu.
Không chỉ phát hiện bệnh, công nghệ nano còn hỗ trợ điều trị. Hạt nano vàng liên hợp kháng thể có thể tiêu diệt trực tiếp vi khuẩn như tụ cầu vàng khi chiếu tia laser, tạo nên “vũ khí” nhắm trúng đích, hạn chế tổn thương mô lành và giảm nguy cơ kháng thuốc.
Tóm lại, hạt nano liên hợp kháng thể là bước tiến đột phá trong y học, giúp phát hiện vi khuẩn nhanh, chính xác và mở ra tiềm năng điều trị trúng đích trong tương lai, góp phần đưa công nghệ nano trở thành nền tảng của y học chính xác và cá thể hóa.
Hiện nay, bên cạnh các kỹ thuật chẩn đoán hình ảnh quen thuộc như MRI, CT, PET hay siêu âm, công nghệ nano liên hợp kháng thể đang mang đến bước tiến đột phá, giúp phát hiện khối u sớm hơn, chính xác hơn và điều trị hiệu quả hơn.
Nhờ khả năng nhận diện chính xác tế bào ung thư, các hạt nano gắn kháng thể có thể tìm đến đúng vị trí khối u, hỗ trợ bác sĩ quan sát rõ ràng ranh giới u, xác định hạch bạch huyết liên quan và theo dõi đáp ứng điều trị. Trong điều trị, liệu pháp kháng thể liên hợp thuốc (ADC) thế hệ mới giúp đưa thuốc hóa trị trực tiếp vào tế bào ung thư, giảm ảnh hưởng đến mô lành và hạn chế độc tính toàn thân.
Đặc biệt, các hạt nano từ tính, nano vàng, liposome, micelle hay dendrimer được kết hợp với kháng thể đặc hiệu như HER2 đã chứng minh hiệu quả cao trong điều trị ung thư vú, gan và nhiều loại ung thư khác. Những hệ thống này giúp tập trung thuốc tại khối u, tăng khả năng tiêu diệt tế bào ung thư và giảm tác dụng phụ.
Công nghệ nano không chỉ mở ra kỷ nguyên chẩn đoán sớm và điều trị trúng đích, mà còn đặt nền móng cho y học cá thể hóa, nơi mỗi bệnh nhân được điều trị bằng giải pháp phù hợp nhất với đặc điểm bệnh lý của chính họ. Đây là một bước tiến lớn hướng tới tương lai điều trị ung thư an toàn và hiệu quả hơn.
Tân mạch hóa là sự xuất hiện bất thường của các mạch máu mới trong mắt, chính là nguyên nhân hàng đầu gây giảm thị lực và mù lòa ở nhiều bệnh lý như thoái hóa hoàng điểm tuổi già, bệnh võng mạc đái tháo đường, viêm võng mạc hay tắc mạch võng mạc.
Hiện nay, thuốc kháng VEGF được xem là bước tiến lớn trong điều trị các bệnh lý này. Trong đó, Bevacizumab (Avastin) là một kháng thể đơn dòng có khả năng ức chế sự phát triển của mạch máu mới, dù ban đầu được phát triển để điều trị ung thư, nhưng đã chứng minh hiệu quả rõ rệt khi sử dụng trong các bệnh mắt có tân mạch.
Phương pháp tiêm nội nhãn giúp đưa thuốc trực tiếp vào mắt, đạt nồng độ cao tại võng mạc, chính là nơi tổn thương xảy ra và mang lại hiệu quả rõ rệt hơn so với nhỏ thuốc hay dùng toàn thân. Tuy nhiên, việc tiêm lặp lại nhiều lần gây ra những rủi ro như xuất huyết dịch kính, bong võng mạc, đục thủy tinh thể, viêm nội nhãn, cùng chi phí điều trị cao và cảm giác đau đớn khiến người bệnh khó duy trì và tuân thủ phác đồ điều trị lâu dài.
Để khắc phục hạn chế này, công nghệ hạt nano đang được nghiên cứu nhằm kéo dài thời gian tác dụng của thuốc và giảm số lần tiêm. Các hạt nano như liposome, PLGA hay chitosan giúp thuốc phân bố đều, duy trì nồng độ ổn định trong mắt từ 6 – 8 tuần, thậm chí lâu hơn, đồng thời hạn chế tác dụng phụ.
Nhiều nghiên cứu cho thấy hạt nano bevacizumab không chỉ giúp ức chế mạnh sự hình thành mạch máu bất thường mà còn an toàn, ít gây viêm, mở ra hướng điều trị hiệu quả, an toàn và bền vững hơn cho các bệnh lý tân mạch ở mắt.
Các bệnh hô hấp mạn tính như hen suyễn, bệnh phổi tắc nghẽn mạn tính (COPD) hay dị ứng đường hô hấp đang ngày càng phổ biến và là nguyên nhân hàng đầu gây bệnh tật, tử vong trên toàn cầu. Việc điều trị hiện nay chủ yếu dựa vào thuốc giãn phế quản và corticosteroid dạng hít, tuy nhiên không phải lúc nào cũng kiểm soát được tình trạng viêm kéo dài ở đường thở.
Trong bối cảnh đó, liệu pháp sinh học, đặc biệt là kháng thể đơn dòng đang mở ra hướng điều trị mới, giúp tác động chọn lọc vào các yếu tố gây viêm, cải thiện kết quả điều trị cho người bệnh. Một số kháng thể nhắm vào cytokine và chemokine đã cho thấy tiềm năng rõ rệt trong kiểm soát viêm phổi mạn và hen suyễn nặng.
Đáng chú ý, công nghệ nano đang góp phần nâng cao hiệu quả của các thuốc sinh học này. Nhờ khả năng bảo vệ thuốc khỏi bị phân hủy, thâm nhập sâu vào mô phổi và duy trì nồng độ ổn định, hạt nano giúp tăng hiệu quả điều trị, giảm tác dụng phụ và kéo dài thời gian tác dụng. Đặc biệt, việc phối hợp kháng thể đặc hiệu với hạt nano oxit sắt từ tính (SPION) cho phép theo dõi tình trạng viêm phổi và sự hoạt động của đại thực bào qua hình ảnh MRI một cách chính xác, an toàn và không xâm lấn.
Các nghiên cứu mới còn cho thấy tiềm năng của thuốc kháng IL-8, TNF-α hoặc cetuximab trong điều trị COPD, nhất là khi kết hợp với công nghệ hạt nano giúp thuốc được đưa trực tiếp vào phổi qua đường hít, tăng nồng độ tại chỗ và giảm rủi ro toàn thân.
Nhờ sự kết hợp giữa công nghệ nano và liệu pháp kháng thể đơn dòng, y học hô hấp đang tiến gần hơn tới mục tiêu chẩn đoán sớm, điều trị trúng đích và cá thể hóa, mang lại hy vọng mới cho hàng triệu người bệnh mắc các bệnh phổi mạn tính.
Trong đại dịch, kháng thể đơn dòng nổi lên như liệu pháp hứa hẹn trong kiểm soát COVID-19, đặc biệt ở bệnh nhân có nguy cơ cao. Nhờ khả năng gắn đặc hiệu vào protein virus, hoạt chất này giúp giảm tải lượng SARS-CoV-2, ngăn bệnh tiến triển nặng và hỗ trợ phục hồi sớm. Các nghiên cứu lâm sàng đã thúc đẩy sự ra đời của nhiều thế hệ kháng thể tổng hợp, góp phần mở rộng lựa chọn điều trị và phòng ngừa cho cộng đồng.
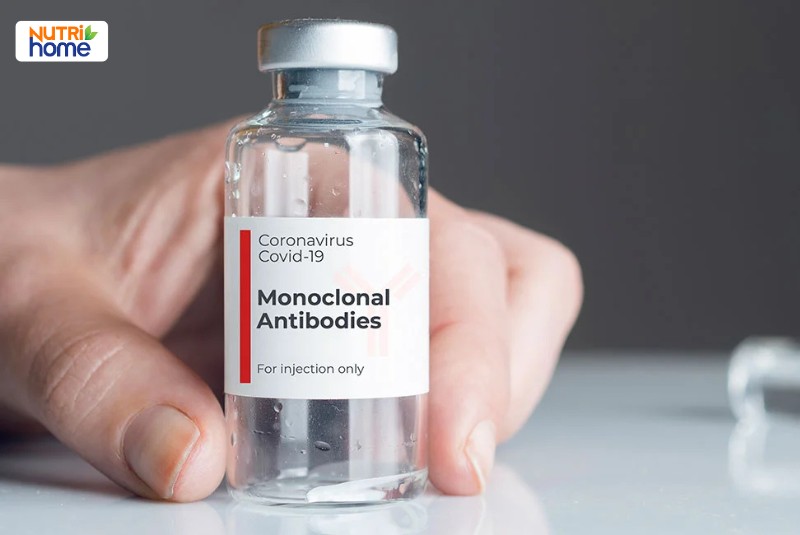
Kháng thể đơn dòng được xác định là liệu pháp tiềm năng để ngăn ngừa sự tiến triển của COVID-19 ở những bệnh nhân có nguy cơ cao mắc bệnh nặng.
Song song đó, lĩnh vực hô hấp cũng ghi nhận bước tiến lớn với Palivizumab và Nirsevimab trong dự phòng RSV. Nếu như chế phẩm đầu tiên yêu cầu tiêm lặp lại hàng tháng thì Nirsevimab chỉ cần một liều duy nhất mỗi mùa dịch, bảo vệ kéo dài đến 6 tháng. Các thử nghiệm quốc tế chứng minh hiệu quả vượt trội trong giảm nhập viện, hạn chế viêm phổi nặng, từ đó được WHO, CDC và EMA khuyến nghị triển khai cho trẻ sơ sinh và nhóm nguy cơ cao.
Kháng thể đơn dòng thế hệ mới Beyfortus (Nirsevimab) liều lượng 50mg/ 0.5ml.
Với sự phát triển mạnh mẽ của công nghệ sinh học, ngày càng có nhiều loại kháng thể đơn dòng được đưa ra thị trường, mỗi loại mang đặc tính riêng biệt về cấu trúc, cơ chế tác động và chỉ định điều trị. Một số loại kháng thể đơn dòng phổ biến trên thị trường có thể kể đến như sau:
Danh sách một số kháng thể đơn dòng đang lưu hành
| Tên thuốc | Tên thương mại | Địch tác động | Chỉ định | Thời điểm được Hoa Kỳ chấp thuận |
| Nirsevimab | Beyfortus | RSV; IgG1 của người | Nhiễm trùng RSV | 2023 |
| Palivizumab | Synagis | RSV; IgG1 nhân tạo | Phòng ngừa nhiễm trùng virus hợp bào hô hấp RSV | 1998 |
| Rituximab | MabThera® Rituxan® |
CD20 (trên tế bào B) | Lymphoma không Hodgkin, Bạch cầu lymphocytic mãn tính (CLL), Viêm khớp dạng thấp | 1997 |
| Trastuzumab | Herceptin® | HER2 (thụ thể yếu tố tăng trưởng biểu bì 2) | Ung thư vú HER2+, Ung thư dạ dày HER2+ | 1998 |
| Bevacizumab | Avastin® | VEGF-A (yếu tố tăng trưởng nội mô mạch máu) | Ung thư đại trực tràng, phổi, thận, glioblastoma | 2004 |
| Adalimumab | Humira® | TNF-alpha (cytokine gây viêm) | Viêm khớp dạng thấp, bệnh Crohn, viêm loét đại tràng, viêm cột sống dính khớp, vảy nến | 2002 |
| Infliximab | Remicade® | TNF-alpha | Viêm khớp dạng thấp, bệnh Crohn, viêm loét đại tràng | 1998 |
| Tocilizumab | Actemra® | IL-6 receptor | Viêm khớp dạng thấp, hội chứng giải phóng cytokine (CRS), COVID-19 nặng | 2010 |
| Omalizumab | Xolair® | IgE | Hen phế quản dị ứng, mề đay mạn tính tự phát | 2003 |
| Natalizumab | Tysabri® | α4-integrin | Đa xơ cứng thể tái phát (MS), bệnh Crohn | 2004 |
| Pembrolizumab | Keytruda® | PD-1 (thụ thể ức chế miễn dịch) | Nhiều loại ung thư: phổi, hắc tố, dạ dày, cổ tử cung,… | 2014 |
| Nivolumab | Opdivo® | PD-1 | Ung thư phổi, thận, gan, hắc tố, thực quản… | 2014 |
| Cetuximab | Erbitux® | EGFR | Ung thư đại trực tràng, ung thư đầu cổ… | 2004 |
| Atezolizumab | Tecentriq® | PD-L1 | Ung thư phổi, ung thư bàng quang | 2016 |
| Daratumumab | Darzalex® | CD38 | Đa u tủy xương (multiple myeloma) | 2015 |
LƯU Ý QUAN TRỌNG: Trên thực tế, hiện nay có hàng trăm loại kháng thể đơn dòng đã được chấp thuận lưu hành trên thị trường toàn cầu và con số này vẫn đang không ngừng tăng lên nhờ những bước tiến vượt bậc của y học hiện đại. Trong tương lai, các liệu pháp kháng thể đơn dòng được kỳ vọng sẽ mở rộng hơn nữa, không chỉ trong điều trị ung thư mà còn ở nhiều lĩnh vực khác như bệnh tự miễn, tim mạch, nhiễm trùng và cả các bệnh hiếm.
Để tìm hiểu thông tin cụ thể về các loại kháng thể đơn dòng đang được sử dụng tại Việt Nam, người dân nên liên hệ các cơ quan y tế trực thuộc Bộ Y tế, bệnh viện hoặc cơ sở y tế uy tín gần nhất để được tư vấn chi tiết, chính xác và phù hợp với tình trạng sức khỏe của mình.
Trong kỷ nguyên y học hiện đại, kháng thể đơn dòng đã và đang khẳng định vai trò quan trọng trong điều trị nhiều bệnh lý phức tạp nhờ vào tính đặc hiệu và hiệu quả vượt trội. Một số ưu điểm nổi bật của loại kháng thể này trong điều trị như sau:
Kháng thể đơn dòng thường được truyền tĩnh mạch trong môi trường y tế được giám sát chặt chẽ. Do bản chất là protein ngoại lai, quá trình truyền có thể gây phản ứng truyền, tương tự phản ứng dị ứng, thường xuất hiện trong lần truyền đầu tiên.
Biểu hiện phổ biến sau tiêm gồm sốt, ớn lạnh, mệt mỏi, đau đầu, buồn nôn, tiêu chảy, phát ban hoặc tụt huyết áp nhẹ. Chẳng hạn, Bryfortus có thể gây ra các phản ứng thường gặp sau tiêm như
So với thuốc hóa trị truyền thống, kháng thể đơn dòng nhìn chung ít gây tác dụng phụ nghiêm trọng hơn, song vẫn có thể phát sinh phản ứng tùy theo đích tác động sinh học. Chẳng hạn, Bevacizumab (Avastin) là kháng thể nhắm vào protein VEGF giúp ức chế hình thành mạch máu nuôi khối u có thể gây tăng huyết áp, chậm lành vết thương, chảy máu hoặc tổn thương thận. Trong khi đó, Cetuximab (Erbitux) là nhắm vào thụ thể EGFR trên tế bào da và tế bào ung thư, đôi khi gây phát ban nghiêm trọng.
Trong suốt quá trình sử dụng kháng thể đơn dòng nói chung, người được tiêm phải luôn được đội ngũ y tế theo dõi sát, sẵn sàng xử trí mọi phản ứng bất thường. Việc thông báo sớm cho bác sĩ khi có dấu hiệu khác lạ như khó thở, phát ban, chóng mặt hay đau ngực giúp ngăn ngừa biến chứng và đảm bảo hiệu quả điều trị an toàn.
Kháng thể đơn dòng có thể gây ra một số phản ứng phụ sau tiêm cần phải lưu ý.
Điều trị bằng kháng thể đơn dòng là một quy trình y khoa tiên tiến nhưng đòi hỏi sự chuẩn bị kỹ lưỡng và theo dõi chặt chẽ, do có thể gây ra các phản ứng nghiêm trọng như sốt, ớn lạnh, phản ứng dị ứng hoặc rối loạn tim phổi. Việc điều trị phải được tiến hành trong cơ sở y tế đủ năng lực chuyên môn, có trang thiết bị cấp cứu và đội ngũ được đào tạo bài bản.
Trong mọi tình huống khẩn cấp, đội ngũ y tế phải sẵn sàng xử trí phản vệ và hỗ trợ hô hấp tuần hoàn ngay lập tức. Sự chuẩn bị kỹ lưỡng trong từng khâu là yếu tố then chốt giúp điều trị bằng kháng thể đơn dòng đạt hiệu quả tối ưu và đảm bảo an toàn cho người sử dụng sinh phẩm này.
Để được tư vấn chi tiết về liệu pháp điều trị bằng kháng thể đơn dòng, quy trình theo dõi, cũng như các phương án chăm sóc chuyên sâu phù hợp với từng trường hợp, người bệnh có thể liên hệ hotline Hệ thống Bệnh viện Đa khoa Tâm Anh để được các chuyên gia đầu ngành hỗ trợ và hướng dẫn cụ thể.
Kháng thể đơn dòng được xem là bước tiến đột phá của y học hiện đại, mở ra kỷ nguyên mới trong điều trị trúng đích và y học cá thể hóa. Không chỉ mang lại hiệu quả cao trong điều trị ung thư, bệnh tự miễn và các bệnh nhiễm trùng nguy hiểm, liệu pháp này còn giúp giảm độc tính, nâng cao chất lượng sống và kéo dài tiên lượng cho người bệnh. Tuy nhiên, việc sử dụng kháng thể đơn dòng cần được chỉ định, theo dõi nghiêm ngặt bởi bác sĩ chuyên khoa, đảm bảo an toàn và hiệu quả tối ưu. Chủ động thăm khám, tư vấn tại các cơ sở y tế uy tín là cách tốt nhất để tiếp cận và hưởng lợi từ những thành tựu tiên tiến của liệu pháp này.